 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)  Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'Oxygène et la Vie: Tome II - L'Oxygène en Pathologie des Mammifères
Mitochondries et métabolisme de l'oxygène
Première partie: Mitochondries et oxygénation
Carol Deby
| Note: pour la facilité de la lecture, 1. chaque référence dans le texte comporte un lien vers les pages de bibliographie 2. les abréviations et les formules chimiques sont reprises dans les pages du glossaire ; elles sont également identifiées directement dans le texte (apparition en arrière plan lors du pointage de la souris) |
1. Physiologie du calcium mitochondrial
L'ion Ca2+ joue un rôle-clé dans la régulation des fonctions mitochondriales, agissant à divers niveaux dans cette organelle (Brookes et al., 2004). Il joue un rôle important dans la transmission des signaux transmitochondriaux (Sedova et al., 2006).
A. Stockage temporaire du Ca2+ cellulaire («mitochondrial cycling»)
Au niveau des muscles, le réticulum sarcoplasmique joue le rôle de réserve de calcium, régulant les cycles de contraction-relaxation.
Une élévation importante des ions calciques cytosoliques peut se produire durant diverses circonstances anormales : ischémie, trauma, etc… Cette hausse active diverses lipases et phosphatases pouvant provoquer la mort de la cellule. Parmi les « dissipateurs » de calcium cytosolique existe le stockage temporaire du cation dans les mitochondries, qui sera suivi d’un lent retour dans le cytoplasme (phénomène de cycling; voir Falcke et al., 1999). Il y a cependant un seuil de concentration calcique intra-mitochondrial qui ne peut être dépassé sans mette en route de nouveaux mécanismes pathologiques, dont la production de ROS (voir chapitre VI) et l’ouverture du mPTP (voir chapitre VII) conduisant à la mort cellulaire (Korge et al., 2001). Le VDAC (voir ci-dessous) joue un rôle de plus en plus important, à mesure que les travaux avancent, notamment dans la circulation transmembranaire du calcium (Hodge et Colombini, 1997).
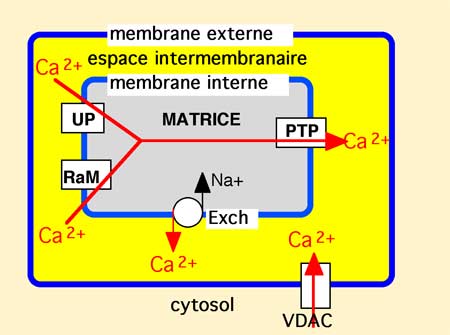
Fig. V-1 : Schéma général de la circulation du Ca2+ dans la mitochondrie (d'après Brookes et al., 2004).
UP : calcium UniPorter; RaM :Rapid mode ; Exch : échangeur Na+/Ca2+ ;
PTP : permeability transition pore ; VDAC : Voltage-Dependent Anion Channel.
B. Rôle du mCU (mitochondrial Ca2+ uniporter) ou UP
Voir Packer et Murphy, 1994 ; Dedkova et Blatter, 2005; Duchen, 2000 ; Rizzuto et al., 2004.
Les mitochondries participent au contrôle homéostasique du Ca2+ (Isaeva et al., 2005). Le prélèvement des ions calciques par ces organelles modifie leur concentration cytosolique (sur l’importance des mitochondries dans la régulation du Ca2+ cytosolique : voir Isaeva et al., 2005).
La captation du calcium par les mitochondries se fait de manière peu régulée par le potentiel de membrane (variations entre –50 et + 50 mV) qui permet l’entrée et la sortie de cet ion au niveau de l’espace intermembranaire.
Mécanismes de contrôle du Ca2+ mitochondrial : le passage de l’espace intermembranaire dans la matrice se fait au niveau du canal à Ca2+ uniporteur (mCU) en fonction du gradient de potentiel ΔΨm généré par l’ETC; en revanche, le calcium entraîne un abaissement du ΔΨm (dépolarisation) qui réduit le gradient « aspirateur » de calcium (Gunter et Pfeiffer, 1990)
Il y a un cycle du calcium entre l'espace intermembranaire et la matrice. Les ions calciques entrent dans la matrice par le mCU et en sortent par l'activité du NCE (Na+/Ca2+ exchanger, voir figure V-1 : Exch), par échange avec les ions Na+ (Crompton, 1999).
c. Rôles du Ca2+ dans la mitochondrie
a) régulation de la phosphorylation oxydative, en synergie avec le •NO (voir Chapitre III).
b) intervention dans l’ouverture du mPTP (voir plus bas) et l’apoptose (voir Chapitre VII).
c) au delà d’une certaine concentration, il provoque le swelling de la mitochondrie (voir chapitre VII)
d) production de ROS
2. Circulation d'ions et de molécules
Une excellente revue générale de la question a été publiée en 1999 par Bernardi, complétée par He et Lemasters en 2002.
Plus de 99 % des protéines constitutives des mitochondries sont originaires du cytoplasme. Inversement, l'ATP cellulaire est majoritairement synthétisé dans les mitochondries. D'autre part, les ions tels que le calcium doivent être importés par les mitochondries, de même que les aminoacides destinés à la biosynthèse de protéines par les mitoribosomes.
Il est clair que des passages transmembranaires permettent ces échanges et que, forcément, ils doivent être soumis à une régulation sévère afin que les processus homéostasiques, conditions premières de la vie, soient assurés.
A. Canaux de la membrane interne (voir Quinlan et al., 2008)
Ils permettent à des ions et à des petites molécules de circuler entre la matrice et l'espace intermembranaire.
| Fig. V-2 : Circulation des ions dans la mitochondrie (d’après O'Rourke et al., 2005). Pour mémoire, nous avons esquissé les transports transmembranaires de protons par les complexes I à V de la phosphorylation oxydative. PIC : canal des ions phosphates (Pi) ; ANT : adénine nucléotide translocase, permettant l'entrée d'ADP et la sortie d'ATP ; MCU : mitochondrial Ca2+ uniporter ; NCE : Na+/Ca2+ exchanger ; NHE : Na+/H+ exchanger ; PTP : Permeability Transition Pore ; IMAC : Inner Membrane Anion Channel ; KHE : K+/H+ exchanger ; mitKCa : mitochondrial calcium-activated K+ channel ; mitKATP : mitochondrial ATP-activated K+ channel sous la dépendance du •NO (Lacza et al., 2001). Notons que IMAC transporte divers d’anions (A-) tels que citrate, malate, pyruvate, etc… (Aon et al., 2007 ; O'Rourke et al., 2005). |
1. Les canaux transporteurs de K+ sensibles à l'ATP
Ils sont généralement désignés par leur sigle mitKATP ; leur ouverture permet la circulation des ions K+; ils sont fermés par l'ATP, mais sont ouverts par divers agents (Paucek et al., 1992; Garlid et al., 1996; Costa et al., 2005), notamment par la concentration en •NO (Lacza et al., 2001). Ces canaux modulent la fonction des mitochondries cardiaques (Holmuhamedov et al., 1998).
La bradykinine lance un signal qui atteint et stimule les mitKATP : ceux-ci s'ouvrent, inhibant la transition de perméabilité mitochondriale (mPT) et stimulent la production d'H2O2 (Quinlan et al., 2008). Par cette voie, la bradykinine protège le cœur contre les dommages de l’ischémie–reperfusion, selon une séquence maintenant bien établie (Oldenburg et al., 2004). On leur fait jouer actuellement un grand rôle dans l’empêchement de l’ouverture des pores mPTP, déclencheurs d’apoptose. Leur structure moléculaire a été clarifiée par les travaux d’Aguilar-Bryan et al. (1995) et par ceux d’Inagaki et al. (1995).
2. Les canaux transporteurs de K+ sensibles au Ca2+
Il y a peu de temps que l’on a découvert un deuxième type de canal potassique, le mitKCa, sensible aux ions Ca2+ (Cancherini et al., 2007), qui serait un autre médiateur de cardioprotection dans l’ischémie cardiaque.
3. L'IMAC (Inner Membrane Anion Channel)
Ce canal véhicule une grande variété d'anions (Liu G et al., 1996 ; Beavis et Powers, 2004). Dès 1986, Garlid et Beavis avaient démontré l'existence, dans les membranes des mitochondries, de canaux perméables aux anions ; ce canal devrait assurer l'homéostasie du volume mitochondrial (confirmé par Powers et al., 1994) et est très dépendant de la température et du pH (inhibition par H+); l'ion Mg2+ l'inhibe (Liu G et al., 1996).
| Agents | Auteurs |
|---|---|
| ΔpH élevés | Beavis AD (1992) |
| enlèvement des Mg2+ matriciels | Beavis AD et Garlid KD (1986) |
| ROS | Jezek P et Borecky J (1996) |
| taux de NADH | Aon MA et al. (2003) |
B. Canaux de la membrane externe
La découverte que le cytochrome c peut quitter la mitochondrie, provoquant l'apoptose (Von Ahsen et al., 2000), a déclenché de nombreuses recherches sur l'existence de canaux dans la membrane externe. Auparavant, des observations avaient montré que, dans certaines circonstances, un accroissement brutal et considérable de perméabilité se produisait dans la membrane externe, amenant souvent la mort de la cellule ; cette mPT (mitochondrial Permeability Transition) est étudiée à part dans le chapitre VII.
La protéine la plus abondante isolée de la membrane externe est celle qui fut dénommée "voltage-dependent anion-selective channel" (VDAC); on estime qu'elle constitue une voie critique pour les flux de métabolites entre l’espace intermembranaire et le cytosol ; elle est régulée par le NADH (Zizi et al., 1994) et le potentiel de membrane. Nous l’étudions plus en détail en fin de chapitre. Des translocases ont été identifiées (Muro et al., 2003) ainsi qu'une perméabilité ionique de la membrane externe par le VDAC (Murata et al., 2001).
Au niveau de la membrane externe, les problèmes se posent pour les protéines entrant dans la mitochondrie. Ces grosses molécules doivent être guidées vers leur site d’arrimage par des protéines-guides sorties des mitochondries, comme nous l’avons déjà annoncé dans le chapitre I.
1. Les transporteurs protéiques
Lecture recommandée: Chacinska et al., 2009 « Importing mitochondrial proteins ; machineries and mechanims »
Nous avons vu que plus de 99% des protéines existant dans les mitochondries proviennent du cytoplasme et doivent donc franchir la membrane externe et éventuellement la membrane interne. Elles le font pour la plupart à l'état de pré-protéines, souvent munies d’une séquence dont l’ablation par une protéase donne la protéine.
Deux classes principales de pré-protéines, ou protéines-précurseurs, peuvent être distinguées:
1. Les pré-protéines hydrophiles, linéaires, avec une séquence terminale de reconnaissance clivable ; ces molécules traversent les membranes externes et internes par l'action de translocases TOM et TIM (voir ci-dessous).
2. Les pré-protéines ayant une autre conformation, notamment les protéines transporteuses d'ADP et d'ATP (ADP ATP Carrrier : AAC) qui sont les plus abondantes de cette catégorie et sont escortées par des protéines chaperons (Truscott et al., 2002).
a. La machinerie TIM/TOM
Les translocations de protéines ont lieu au niveau de complexes d'importation enzymatiques, les translocases, désignés par le sigle TOM (Translocase of Outer Membrane) au niveau de la membrane externe et TIM (Translocase of Inner Membrane) dans la membrane interne (Truscott et al., 2002). Ces translocases se comportent comme des pores fixes, des portails.
La première porte d’entrée, pour presque toutes les protéines mitochondriales solubles d’origine cytosolique, est le complexe TOM. Les énergies requises pour ces transferts dépendent, soit de l’ATP, soit de la force protonomotrice. Des transporteurs de nature polypeptidique ou protéique interviennent pour ce trafic entre cytoplasme et espace intermembranaire mitochondrial. Ils sont encodés par les gènes nucléaires.
TOM permet l'importation et le tri de ces protéines : une partie restera dans les espaces intermembranaires, une autre franchira le portail TIM23 et ces protéines gagneront leur place dans la matrice (figure V-3).
Les TOM sont des complexes protéiques formés par 7 éléments (récepteurs de surface, pores de translocation).
Les TIM sont des complexes plus compliqués : 9 structures protéiques débordant largement de part et d'autre de la membrane interne, avec un moteur fonctionnant à l'ATP pour l'importation des protéines (Neupert et Hermann, 2007).
Les chaperones sont des protéines connues sous le sigle HSP (heat shock proteins), telle que la HSP60. Elles permettent aux pré-protéines d'être transportées dans le milieu aqueux des espaces intermembranaires.
b. La machinerie SAM (Sorting and Assembling Machinery) traverse la membrane externe et s’occupe des protéine insolubles.
C'est un ensemble protéique qui trie (« to sort ») et assemble les protéines de la membrane externe où elles gagnent leur place, ou laisse entrer les protéines insolubles dans l’espace intermembranaire où elles sont prises en charge par les chaperones qui leur permettront soit de prendre place dans la membrane interne, soit de franchir le portail TIM22, les conduisant au sein de la matrice (figure V-3).
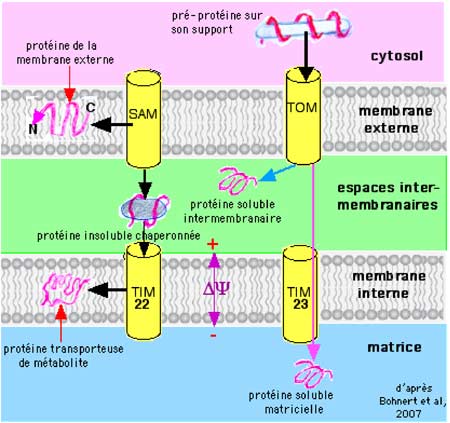
Fig. V-3 : Transport des protéines dans la mitochondrie (d'après Bohnert et al., 2007).
L’adressage des protéines est une découverte relativement récente. Nous recommandons la lecture suivante : Ciblage post–traductionnel des protéines vers les organites. In : T.D. Pollard et W-C Earnshaw, Biologie cellulaire. Elsevier, édit., 2004, p.322 et suivantes.
2. Les canaux drainant les molécules de moins de 5 kDa
a. Transport d'anion superoxyde
Lynch et Fridovich découvrirent en 1978 que l’O2• pouvait traverser la membrane cellulaire et que le DIDS (4,4’-diisothiocyanostilbène-2,2’-disulfonate) inhibe cette pénétration (Lynch et Fridovich, 1978). Ils concluaient à l’existence de canaux à anion superoxyde. Plus tard, on découvrit que le DIDS peut bloquer la sortie de O2• hors de la mitochondrie (Han et al., 2003). On en déduisit que des canaux transporteurs d’O2• existaient également dans les mitochondries ; en 2007, cette hypothèse de base servit à Hawkins et al. pour mener des travaux sur les flux d’O2• via certains canaux (comme le ClC-3) (Hawkins et al., 2007).
b. Les porines
Un livre a été consacré en 2004 aux porines, passages transmembranaires qui assurent la circulation dans les mitochondries de petites molécules chargées électriquement (Benz, 2004). Ces canaux ont été découverts d’abord chez les bactéries ; ils laissent passer dans les deux sens, de manière apparemment non sélective, des molécules de moins de 5 kDa. Les porines sont représentées comme des sortes de tonnelets formés par l’assemblage de feuillets ménageant un canal qui traverse la membrane externe. On trouve de telles structures conductrices chez les Eucaryotes : ce sont les VDAC (Karp et al., 2004).
Fig. V-4 : Schéma général d’une porine.
Les VDAC sont les porines des mammifères. Leur canal ne dépasse pas 2,5 nanomètres de diamètre.
Ils existent sous trois isoformes chez les mammifères. Ils sont présents dans d’autres membranes cellulaires que la membrane externe mitochondriale (Shoshan-Barmatz et Israelson, 2005). Ces canaux sont considérés comme les voies de passage de molécules de moins de 5kDa, les plus importantes de la membrane externe (Hodge et Colombini, 1997).
Ces porines de 31 kDa sont des canaux dont la circulation est à double sens, mesurant environ 2,5 nanomètres, ce qui est trop étroit pour des protéines repliées comme le cytochrome c dont le passage dans le cytosol amorce l’apoptose (Lemasters et Holmuhamedov, 2006) (voir chapitre VII). C’est la voie d’entrée des acides gras, du pyruvate, des nucléotides et des aminoacides (Mannella, 1998) et, d’une manière générale, de tous les métabolites entrant ou quittant la mitochondrie, sauf pour quelques composés lipophiles comme l’oxygène et les acides gras de courte chaîne qui traversent partout les structures phospholipidiques (Lemasters et Holmuhamedov, 2006).
Les anions passent plus facilement que les cations.
- Effet du voltage : c’est aux environs de 0 mV que les VDAC sont les plus conducteurs ; plus on se rapproche de + ou de - 50mV, plus la conductivité s’affaiblit.
- Effet du pH : un abaissement du pH peut fermer le VDAC (Mannella, 1998).
- Inhibiteurs du VDAC : le DIDS, 4,4’-diisothiocyanatostilbène-2,2’-disulfonate (Shafir et al., 1998), le polyanion de Konig (Madesh et al., 2001).
d. Transport d’ADP et d’ATP
L'AAC (ADP ATP Carrrier) est, parmi les molécules transporteuses, l’une des plus importantes : elle assure l'importation dans la matrice de l'ADP et la sortie de l'ATP (Duyckaerts et al., 1980 ; Dahout-Gonzalez et al., 2006). Le franchissement de la membrane externe se fait par un pore VDAC, dans le sens de l’entrée dans l’espace intermembranaire pour l’ADP, de la sortie vers le cytosol pour l’ATP.
Sur la figure V-2, nous constatons la présence d’un canal spécifique, l’ANT, dans la membrane interne, permettant à l’ATP de sortir de la matrice et à l’ADP d’y entrer. Des inhibiteurs de l’ANT sont l'ATR (atractyloside) et le CATR, dérivé carboxy de l’ATR (Dahout-Gonzalez et al., 2006).
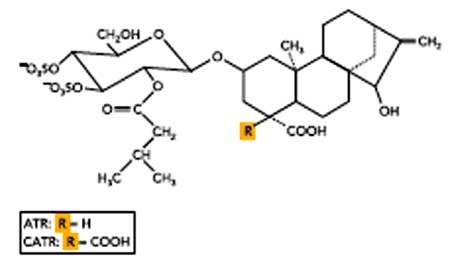
Fig. V-5 : Atractylosides
Mitochondrie et oxygénation - Chapitre VI:Production d'espèces activées de l'oxygène |
Troubles de l'oxygénation et mitochondries - Sommaire |
Mitochondries et métabolisme de l'oxygène - Introduction |
 |
 |
 |